カルニチンがミトコンドリア機能障害に効く理由
まとめ:カルニチンは、酸化ストレス病態で発生する急性の脂肪酸毒性に対する解毒剤として働き、慢性疲労を改善します。
ミトコンドリアには2つの役目があります。①酸素を使ってATPを産生する役割と、②細胞の自殺であるプログラム細胞死(アポトーシス)の調節です。ミトコンドリアはアポトーシス誘導物質であるシトクロームcの放出をきっかけとして、カスパーゼ経路を介して細胞をアポトーシスに導きます。(2013, 矢野)
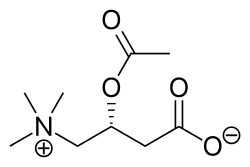
カルニチンはミトコンドリアへの脂肪酸の運搬(カルニチンシャトル)を行っています。
ME/CFSなどの慢性炎症病態では、酸化ストレスが増えることが一般的です。(2021, Maes)
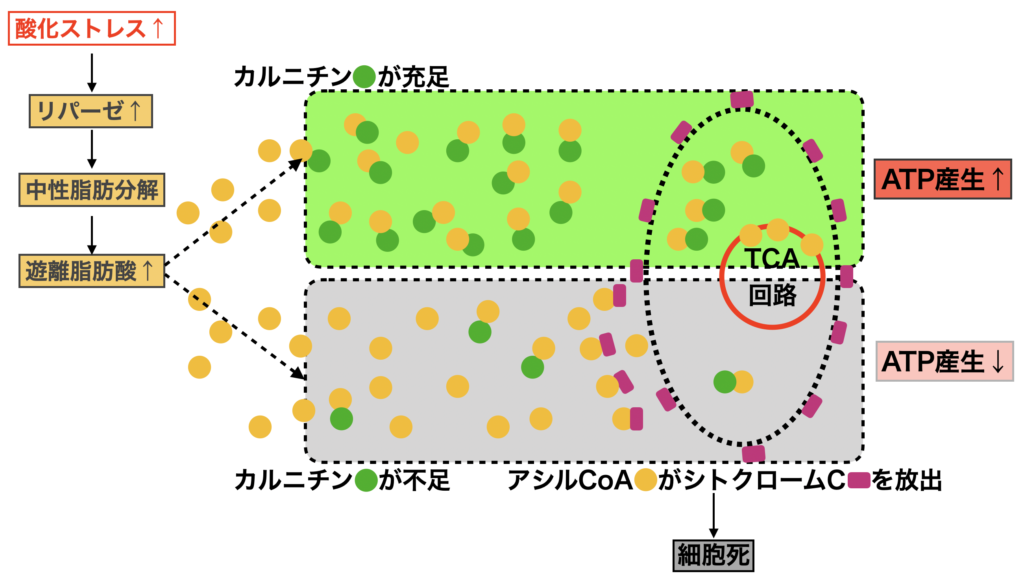
酸化ストレスによってリポタンパク質リパーゼが誘導されて(2015, Peng)、中性脂肪が遊離脂肪酸とグリセロールに分解されて、血液中の遊離脂肪酸が増え、細胞内の脂肪酸(アシルCo-A)も蓄積します。
新型コロナ感染症ではリパーゼが上昇しており(2020, McNabb-Baltar)、膵臓とは関係なく、新型コロナ感染症の重症度と関係しています。(2021, Ramsy)新型コロナ感染症の入院患者の20%にリパーゼの上昇が認められます。
ME/CFS患者の代謝プロファイリングでは、脂肪酸および脂質代謝の障害が報告されています。(2017, Germain)
血清遊離脂肪酸 (FFA) の上昇と肝細胞のリポアポトーシスは、非アルコール性脂肪肝疾患の特徴です。(2006, Mahi)
新型コロナウイルスやそのワクチンのスパイクタンパク質は、ACE受容体に結合して血管内皮細胞のミトコンドリアにレドックス不均衡を起こし、血管内皮細胞の損傷し、血栓を誘発することが報告されています。(2021, Lei)(2021, Giord)(2021, Kaundai)
脂肪酸(アシルCo-A)は通常は速やかにカルニチンによってミトコンドリア内に運ばれてβ酸化によってアセチルCoAとなりTCAサイクルに入ります。(カルニチンシャトル)脂肪酸が蓄積停滞すると界面活性剤として働き膜電位を変化させて、ミトコンドリアの内膜に弱く結合しているシトクロームC(電子伝達系の主要構成要素)をミトコンドリアから引き剥がし、外に放出させて、細胞のプログラム細胞死(アポトーシス)に導きます。アシルCo-Aが、アポトーシスを招く脂肪毒として作用します。
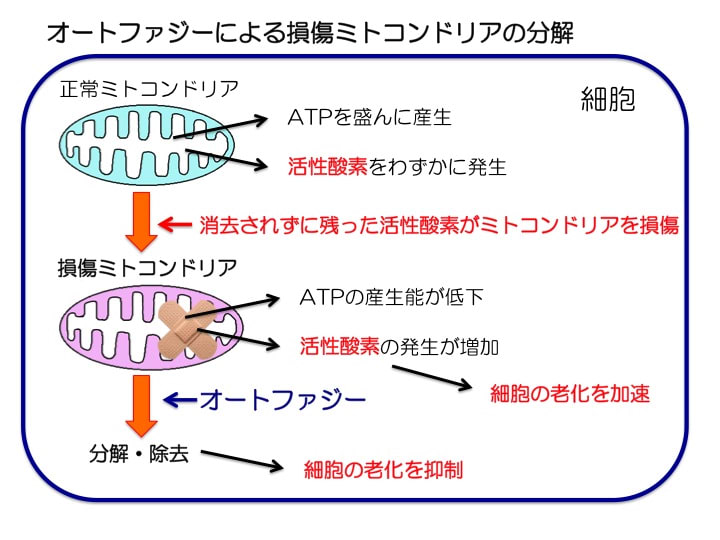
損傷されたミトコンドリアは通常であればオートファジーによって分解・除去されます。
急性膵炎の時は、血中にリパーゼが放出されるために、全身で脂肪毒の影響を受けて細胞死が起こりますが、脂肪酸と結合するカルニチンを投与することで改善することが報告されています。(2009, Arafa)カルニチンは脂肪毒に対する解毒剤として作用します。