ワクチンが仇になる理由
まとめ:新型コロナは、変異の激しいRNAウイルスです。武漢型ワクチン接種者が増えることなどによって、ワクチンの標的タンパクであるスパイクタンパク質に集中して変異が起こったワクチンエスケープバリアントが次々と出現しています。
この変異種に対する武漢型ワクチン接種では、変異してしまったスパイクタンパク質に対する中和抗体の効果が不十分であり、非中和抗体による抗体依存性感染増強(ADE)が起こる可能性があります。
もともと重症化リスクの低い子供は、逆説的にワクチン誘発性ADEによる重症化リスクが懸念されます。
ワクチン非接種者よりもワクチン接種者における宿主内多様性が有意に高いことと、まれではあるものの免疫回避変異の検出は、ワクチン接種者におけるワクチン誘発性免疫圧の可能性を示唆していることが報告されています。(2022, AI-Khatib)
■ウイルスに対する中和抗体と非中和抗体
中和抗体は、追加の支援なしにウイルスの侵入またはその融合を防ぐことができる抗体として定義されます。(2016年、DiLilloら)中和抗体は、ウイルスの受容体とリガンドの相互作用をブロックすると同時に、免疫学的成分とネットワークを形成して、ウイルスを宿主から排除することができます。(2014年、Yasuiら)
SARS-CoV-1のSタンパク質のRBD(受容体結合ドメイン)に高い親和性で結合する中和抗体は、ウイルス-ACE2受容体の結合を防ぎ、ウイルスの侵入を防ぐことができます。(2008年、Piersonら)
抗体依存性感染増強(ADE)は、非中和抗体とウイルスが結合した後、ウイルス粒子および補体成分と相互作用によって、その後の感染を促進します。(2018年、Khandiaら)
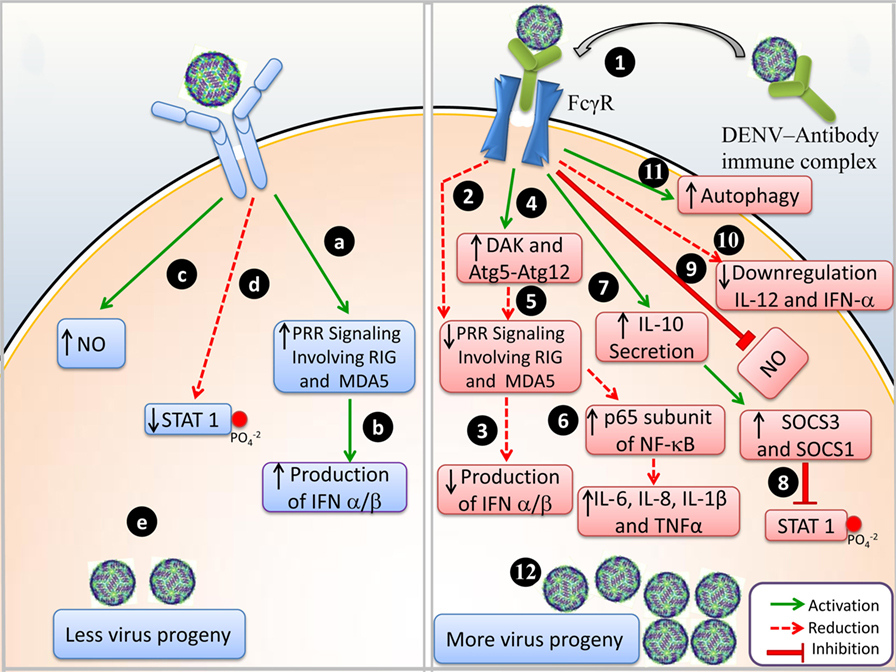
ADEは、非中和抗体による2つの異なるメカニズムによって発生することが報告されています。
①Fcガンマ受容体IIa(FcγRIIa)を発現する食細胞への抗体媒介ウイルス取り込みの増強によるウイルス感染と複製の増加、および②過剰な抗体Fc媒介エフェクター機能によるまたは免疫複合体の形成により、炎症と免疫病理が増強です。(2020年、Leeら)

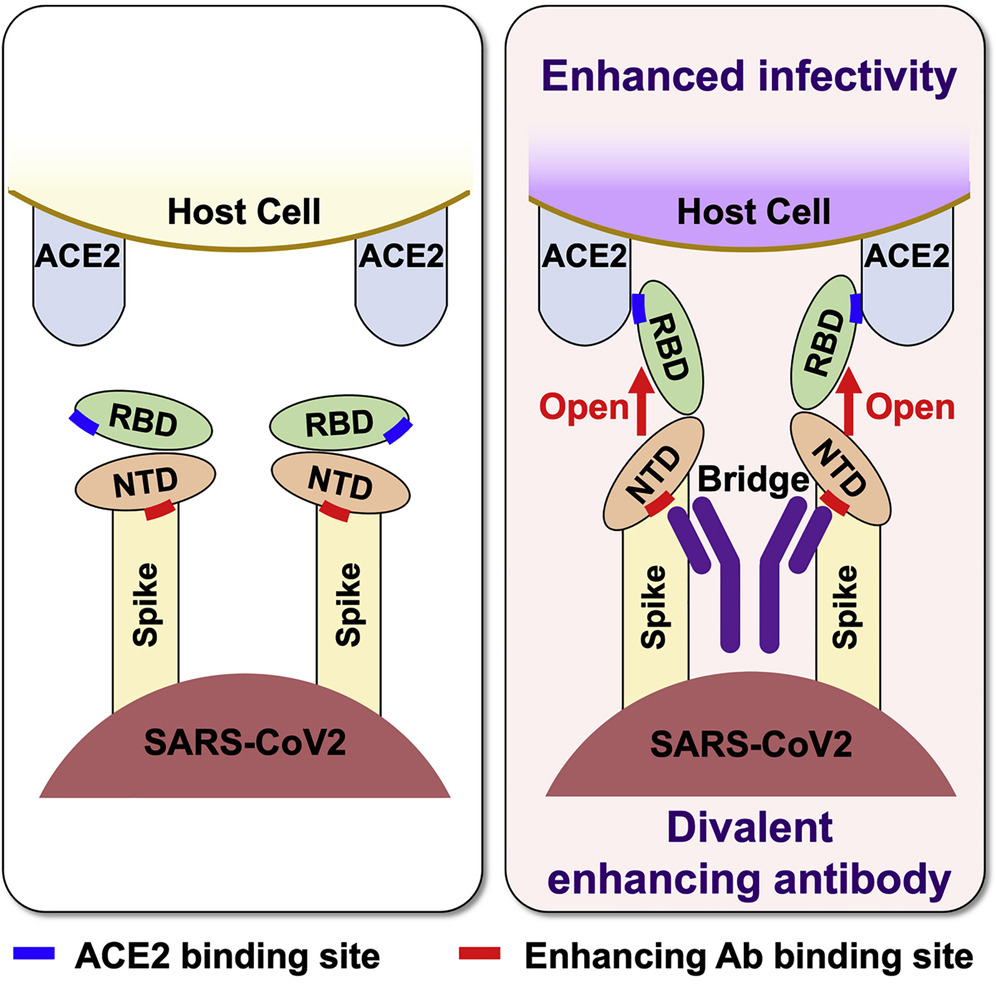
Fc受容体とは別のメカニズムとして、NTDの特定の部位に対する抗体が結合すると、RBDが開いた状態になり、ACE2受容体への結合が強くなりADEが起こることが指摘され、既にこの抗体が重症患者の体内で検出されたことが報告されています。(2021年、Liuら)
■RNAウイルスのADEの歴史
抗体依存性感染増強(ADE)として知られる、ウイルスが体に与える可能性のある損傷を抗体が増幅することがあります。これは、非中和抗体がウイルス感染を促進し、より深刻な病気につながる現象です。現在までに、デング熱ウイルス、SARS-CoV、MERS-CoV、エボラウイルス、インフルエンザウイルスなどのRNAウイルスでADEが報告されています。(2015年、Taylorら)
SARS-CoV-1(SARS-CoV-2と遺伝子の相同性が80%)のスパイクタンパク質に対するワクチン接種をしたマカクザルが、ADEを起こして重症の肺損傷を起こしたことが報告されています。(2019年、Liuら)
RSウイルス、ジカウイルス、口蹄疫、豚繁殖・呼吸障害症候群などのRNAウイルスでもADEは報告されています。(2003年、Takadaら)
ワクチン誘発性ADEは、RSウイルスで報告されています。(2019年、Ruchwardtら)
変異の激しいRNAウイルスは、抗体依存性感染増強(ADE)を起こすために、ワクチンの開発が頓挫して来た歴史から、SARS-COV-2ワクチン開発に警笛が鳴らされて来ました。(2020年のLeeら、2020年のIwasakiら、2021年のChengら)
ワクチン接種が広まるにつれてSARS-CoV-2は免疫選択圧下で進化を続けて、ワクチンエスケープバリアントが進化する可能性が高くなっていることが指摘されています。(2021年、Tregoningら)
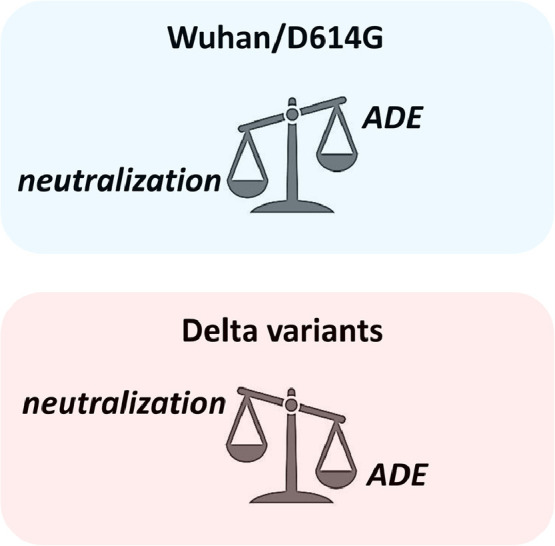
現在のCovid-19ワクチン(mRNAまたはウイルスベクター)は、元の武漢スパイク配列に基づいています。元の武漢型に対しては、中和抗体が促進抗体(非中和抗体)を圧倒しますので、ADEは問題ではありません。しかし、SARS-CoV-2変異株の出現は、ADEを起こす可能性があります。私たちの構造およびモデリングデータは、デルタ株がワクチンエスケープバリアントである可能性を示唆しています。 (2021年、Yahiら)

デルタ株は従来株と比較して、ワクチン接種者から回収された血清中の中和抗体に対する感受性が、1/6~1/8と低く、従来株と比べ6~8倍ほど高い抵抗性を示すということが報告されています。(2021年、Micochovaら)
中和抗体の親和性または濃度を上がるとADEを軽減できますが、反対に非中和抗体の濃度が上がるとADEにつながる可能性があります。(2020年、Quinlanら)
もともと重症化リスクの低い子供は、逆説的にワクチン誘発性ADEによる重症化リスクが懸念されます。(2020年、Tetroら)
■COVID-19を悪化させる非中和抗体の存在は2020年に既に推定されています。
逆説的に、ウイルスに対する抗体が少ないことは、ADEを起こさないので重症化しにくいことが指摘されています。
SARS-CoV-2(SARSコロナウイルス2)は、以下の4つの構造成分によって構成されます。(2021年、Wangら)

COVID-19患者の抗体反応に関する研究では、症状の発症後のすべての時点で、Nタンパク質に対する抗体の力価と、重症度およびウイルス排泄の遅延が相関することが報告されています。(2020年、Tanら)
SおよびNタンパク質に対する抗体の力価がLDH(最も有名な逸脱酵素。 LDHは肝臓、赤血球、筋肉、悪性腫瘍などにあります。 LDHの上昇はこれらの組織の損傷を意味しています。)と相関することも報告されています。(2020年、Jiangら)
旧型コロナに対して持っていた抗体が非中和抗体として働きADEを起こしたことが、COVID-19感染の初期の中国湖南省の重症例で発生するサイトカインストーム症候群に関連することが指摘されています。(2020年、Tetroら)
■SARS-CoV-2ワクチンの長期有効性の問題も指摘されています。
SARS-CoV-2ワクチンの抗体価は、時間の経過に伴って急速に低下することが報告されています。(2021年のLoweら、2021年のLevinら)
はしか、おたふく風邪、風疹に対するワクチンなど、多くのワクチンに関する公表された研究では、中和抗体レベルが毎年5〜10%のわずかな減少を示しています。(2008年、Devidkinら)
SARS-CoV-2感染から回復した人の体液性応答の持続性に関するいくつかの研究では、IgGと中和抗体の両方のレベルが感染後8〜10か月でわずかに減少することが示されました(2021年、Danら)
SARS-CoV-2の感染による自然免疫が、ワクチン接種よりも有利なことが報告されています。。(2021年のAndersonら、2021年のHallら)
SARS-CoV-1感染から回復した患者では、メモリーCD8 + T細胞は6〜11年間持続しました(2006年、Pengら)が、メモリーB細胞とIgG抗体は検出できませんでした。(2011年、Tangら)
SARS-CoV-1から得られた知識は、細胞傷害性CD8 + T細胞応答が長期免疫の鍵であることを示唆しています。
SARS-CoV-2においてもT細胞免疫応答が重症化の決定要因であるとされています。(2022年、Moss)
COVID-19患者のCD8 + T細胞のSARS-CoV-2標的がスパイクタンパク質に位置していないことが報告されていることから、スパイクタンパク質に対するワクチンがT細胞応答をほとんど誘導できない可能性が指摘されています。(2020年、Ferettiら)
SARS-CoV-2の変異はスパイクタンパク質に多くの変異が起こっており(2021年、Taoら)、スパイクタンパク質を標的とした旧型ワクチンの有効性が大幅に低下していることが指摘されています。(2021年、Harveyら)
デルタからオミクロンへの変異は、武漢型ワクチンの標的戦略から逃げるために急速に発達したS関連変異体に集中しており、中和抗体による免疫応答レベルに悪影響を及ぼします。(2022年のPapaniolaouら、2021年のMcCathyら)
SARS-CoV-2オミクロン変異体全体で合計46の突然変異のうち23は、Sタンパク質に属しています。(2022年、Kannanら)

