インスリン抵抗性と糖尿病治療薬
インスリン抵抗性とは、インスリンに対する感受性が低下し、インスリンの作用が十分に発揮できない状態です。インスリン抵抗性とは簡単にいうと「インスリンの効き具合」を意味します。(空腹時血糖値126mg/dl以上、HOMA-IR = 空腹時インスリン値(μU/mL) x 空腹時血糖値(mg/dL) / 405で2.5以上)
インスリンは下記のシグナル伝達のメカニズムで、血糖値を下げます。
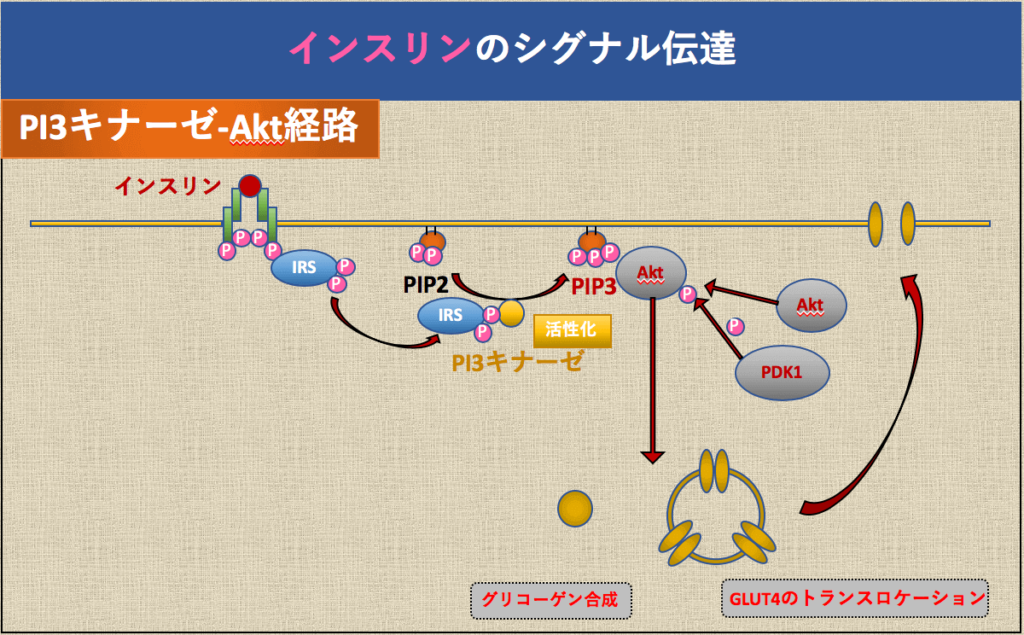
インスリンのシグナル伝達をまとめると、血糖値が上昇したときにはインスリンによって①肝臓と筋肉でのグリコーゲン合成が促進され、②筋肉や脂肪組織に特異的に発現しているGLUT4( インスリン反応性グルコーストランスポーター)のインスリン刺激により細胞膜表面上にトランスロケーションすることによって、細胞内へ糖を取り込みを促進して、血糖値が減少させるということになります。
脂肪・骨格筋におけるインスリン抵抗性は,上述したインスリン情報伝達系のいずれかが障害されることで惹起されます。肥満者では,脂肪細胞の肥大化がみられ,そこから tumor necrosis factor(TNF)-a やレジスチンといったサイトカイン、遊離脂肪酸、さらには酸化ストレスや小胞体ストレスが惹起され、これがインスリン抵抗性を引き起こします。
このインスリン抵抗性の悪化が、いわゆる2型糖尿病の本質です。
そのために、インスリン抵抗性を改善するビグアナイド薬のメトホルミンが原因治療的な効果を持つので、第一選択として使われています。

インスリンによる糖取り込みのメカニズムは,インスリン受容体にインスリンが結合すると,IRS蛋白がリン酸化されてPI3-キナーゼとのカップリングが起こり,糖の輸送担体であるGLUT4が細胞膜表面に移行(トランスロケーション)して糖が取り込まれると考えられています。
アンギオテンシンⅡ(AII)受容体刺激がインスリン刺激と拮抗し,PI3-キナーゼ活性化を抑制,GLUT4の細胞膜表面への移行を抑制すると言われています。
内蔵脂肪細胞に蓄積された中性脂肪が分解されて放出される遊離脂肪酸、内臓脂肪細胞から分泌されるTNF-αは、PI3 キナーゼ活性を抑制し、インスリン抵抗性の原因になります。
細胞での糖や脂質代謝の流れを調節する「代謝センサー」や「燃料ゲージ」とも呼ばれる酵素であるAMPK(AMP-activated protein kinase)は通常では運動や低酸素などで活性化されます。AMPKはGLUT4を細胞表面に移行させ、筋肉がエネルギーを作るために糖分を取り込んだり、脂肪を燃やす働きがあります。
ビグアナイド薬(メトホルミン)はこのAMPKを活性化し「運動疑似効果」を通じて骨格筋および肝臓での脂肪酸酸化を活発にし、糖代謝や高脂血症を改善し抗動脈硬化作用を発揮します。
内臓脂肪細胞から分泌されるアディポネクチンの働きの一つに、筋肉や肝臓にあるAMPKを活性化させる働きがあることが知られています。したがって、有酸素運動にて内臓脂肪を減らすことがアディポネクチンの分泌量を増やすことになります。
運動のもう一つの効能に、血液中のブラジキニン濃度を高め、血管拡張により血圧を下げる効果があることは知られていますが、GLUT4の細胞膜表面に移行させる作用もあります。
ACE阻害薬はレニン・アンギオテンシン系に作用してAⅡの産生を抑制するのみならず、ブラジキニンの不活性化を抑制して血中ブラジキニン濃度を増加させます。
子供の成長と大人の老化の両方に、インスリンが深く関係しています。

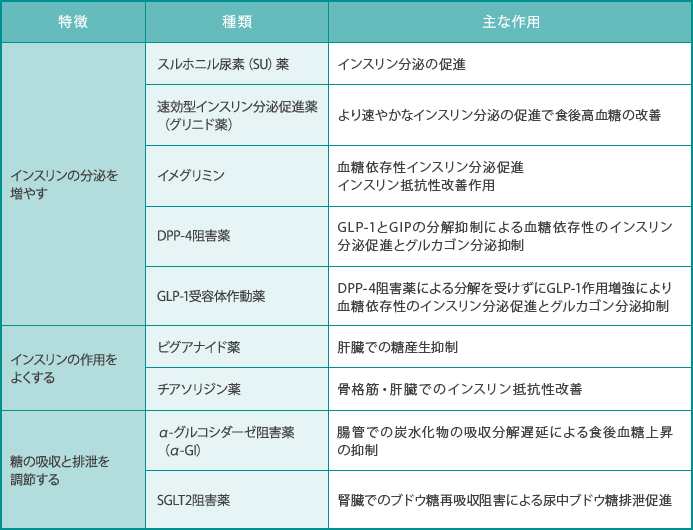
成人では過剰なインスリンは、肥満化、老化、癌化作用のリスクから、インスリン分泌作用を持たない薬が推薦されます。
